Um estudo das Universidades de Bonn e Montreal abre novas formas de produzir compostos químicos importantes
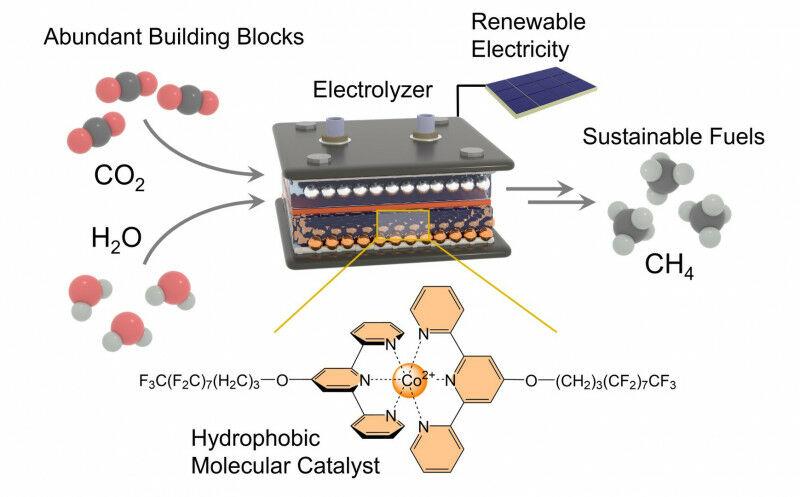
Pesquisadores da Universidade de Bonn e da Universidade de Montreal desenvolveram um novo tipo de catalisador e o utilizaram em seu estudo para produzir metano a partir de dióxido de carbono e água de uma forma altamente eficiente, usando eletricidade. O metano pode ser usado, por exemplo, para aquecer apartamentos ou como matéria-prima na indústria química. É também o principal componente do gás natural. No entanto, se for produzido com eletricidade verde, é em grande parte neutro para o clima. Os insights obtidos com o sistema modelo estudado pelos pesquisadores podem ser transferidos para catalisadores técnicos em larga escala. O sistema também poderia ser usado para produzir outros compostos químicos importantes. O estudo foi publicado recentemente na prestigiada revista “Nature Chemistry”.
Muitas reações químicas requerem energia para começar e esta energia pode ser adicionada, por exemplo, aquecendo os parceiros de reação ou submetendo-os a alta pressão. “Em vez disso, usamos a eletricidade como força motriz”, explica Nikolay Kornienko. “Ao utilizar eletricidade amiga do clima, podemos produzir, por exemplo, metano que não contribui para o aquecimento global.”
O pesquisador mudou recentemente da Universidade de Montreal para o Instituto de Química Inorgânica da Universidade de Bonn. Ele iniciou seu último estudo ainda no Canadá e o concluiu em sua nova casa. “A produção de metano – que tem fórmula química CH4 – é um desafio porque é necessário realizar uma reação entre um gás e um líquido”, diz Kornienko.
Neste caso, estamos falando de dióxido de carbono (CO2) e água (H2O). Os pesquisadores usaram um eletrodo de difusão de gás para unir esses dois parceiros. Na reação, é necessário separar os dois átomos de oxigênio (símbolo químico: O) do átomo de carbono (C) e substituí-los por quatro átomos de hidrogênio (H). O hidrogênio é proveniente da água.
Prevenindo reações colaterais
O problema com este processo é que a água prefere sofrer outra reação e se dividirá em hidrogênio e oxigênio assim que for exposta a uma corrente elétrica. “Esta é uma reação competitiva que devemos evitar”, enfatiza o assistente de Kornienko, Morgan McKee, que realizou grande parte dos experimentos. “Caso contrário, isso nos impediria de produzir metano. Portanto, temos que evitar que a água entre em contato com o eletrodo. Ao mesmo tempo, ainda precisamos da água como parceira de reação.”
É aqui que entra em ação o catalisador recém-desenvolvido – que é depositado no eletrodo. Garante, acima de tudo, que o dióxido de carbono reaja mais rápida e prontamente para produzir metano. Consegue-o com o seu chamado “centro activo” que contém o dióxido de carbono e – em termos simples – também enfraquece as ligações entre o átomo de carbono e os dois átomos de oxigénio.
Esses átomos de oxigênio são então gradualmente substituídos por quatro átomos de hidrogênio na próxima etapa. O catalisador precisa de água nesta fase do processo. No entanto, também deve mantê-lo distante para evitar reações colaterais indesejadas. “Para conseguir isso, ligamos longas cadeias laterais moleculares ao centro ativo”, explica o Prof. Kornienko, que também é membro da Área de Pesquisa Transdisciplinar “Matéria” da Universidade de Bonn. “Sua estrutura química repele a água ou, em outras palavras, são hidrofóbicas”.
Cadeias moleculares que temem água
Este termo especializado vem do grego e significa literalmente “ter medo de água”. As cadeias laterais não apenas mantêm as moléculas de H2O afastadas do centro ativo e do eletrodo, mas também atuam como uma espécie de correia transportadora. Falando figurativamente, eles arrebatam átomos de hidrogênio das moléculas de água e os transportam para o centro ativo, onde reagem com o átomo de carbono. Desta forma, o CO2 é convertido em CH4 em diversas etapas.
Este processo tem uma eficiência de mais de 80% e a reação quase não produz produtos colaterais indesejados. No entanto, o catalisador não é realmente adequado para a produção de metano em larga escala. “Os princípios de reação que alcançamos com este catalisador poderiam, no entanto, ser realizados em outros materiais catalisadores para uso em aplicações técnicas em larga escala”, diz Kornienko.
O pesquisador acredita que a produção de metano não é a única área de aplicação desse método. Na sua opinião, poderia ser mais lucrativo na produção de outros compostos químicos, como o etileno, que é utilizado como matéria-prima para muitos plásticos. A médio prazo, o novo método catalisador poderia assim ser utilizado sempre que possível para tornar a produção de plástico mais amiga do ambiente.