Os receptores acoplados à proteína G (GPCRs) são encontrados em todo o corpo humano e estão envolvidos em muitas vias de sinalização complexas. Apesar da sua importância em muitos processos biológicos, o mecanismo central de acoplamento da proteína G e a transmissão do sinal associado ainda não são compreendidos. Uma equipe de pesquisadores da Universidade de Leipzig conseguiu compreender o mecanismo de transmissão do sinal através de um receptor de ligação à adrenalina em nível atômico. No futuro, os pesquisadores poderão usar esses resultados para evitar melhor os efeitos colaterais no desenvolvimento de medicamentos. O estudo foi publicado na revista Nature Structural & Molecular Biology.
Cada organismo reage ao seu ambiente. Um estímulo externo faz com que o corpo libere mensageiros como a adrenalina, que se ligam aos receptores. Os receptores transmitem o sinal para outras proteínas. Isso desencadeia cascatas bioquímicas que levam a uma resposta no organismo, como uma resposta de fuga ou luta no caso do receptor de ligação à adrenalina. As drogas são frequentemente modeladas com base nesses mensageiros e funcionam interagindo com os receptores. Podem ocorrer efeitos colaterais se o medicamento se ligar ao receptor errado ou não transmitir o sinal para a proteína intracelular correta. Para evitar isso, os cientistas estão estudando como funcionam os receptores. No estudo atual, o professor Peter Hildebrand e sua equipe do Instituto de Física Médica e Biofísica da Universidade de Leipzig mostram como a transmissão do sinal através do receptor adrenérgico ‘2 ocorre no nível atômico. Este é um receptor acoplado à proteína G (GPCR). Os membros desta superfamília de proteínas estão incorporados na membrana celular.
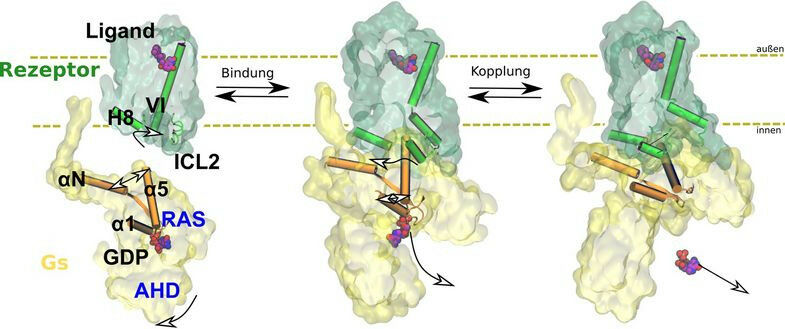
A equipe usou simulações de dinâmica molecular auxiliadas por computador, bem como análises de mutações bioquímicas e funcionais para suas investigações. Isso permitiu observar como o receptor funciona: ao se ligar, o receptor altera a estrutura tridimensional da proteína G intracelular, que então libera a molécula reguladora GDP. Na próxima etapa, essa proteína G pode ser ativada pela ligação ao seu substrato real, GTP, e desencadear cascatas bioquímicas na célula. A equipe de pesquisadores também descobriu que a função exata do receptor depende da disposição de vários elementos estruturais flexíveis. Eles não podem ser caracterizados usando métodos clássicos de biologia estrutural.
O professor Hildebrand está agora a planear aplicar os métodos biofísicos assistidos por computador a outros sistemas receptores, como na investigação da obesidade, um foco da investigação médica na Universidade de Leipzig. “Estudos comparativos de sinalização dinâmica são estimulantes quando são utilizados medicamentos com perfis diferentes”, explica o professor de simulações computacionais biofísicas.
O professor Peter W. Hildebrand pesquisa receptores na Faculdade de Medicina da Universidade de Leipzig desde 2017. De 2008 a 2014, ele estudou a estrutura do fotorreceptor rodopsina com o professor Klaus-Peter Hofmann e o Dr. Patrick Scheerer no Charité. Ele agora também está colaborando com o professor Brian Kobilka, ganhador do Prêmio Nobel, e com o microscopista crioeletrônico Professor Yiorgo Skiniotis, da Universidade de Stanford, EUA, para entender melhor a sinalização mediada por GPCR. Juntos, eles elucidaram recentemente o mecanismo de ligação do GTP à proteína G e sua ativação, e publicaram os resultados na Nature. “Pela primeira vez, temos agora uma imagem abrangente do mecanismo estrutural da sinalização mediada por receptores de fora para dentro da célula”, diz Hildebrand, resumindo sua pesquisa. “Juntamente com os meus colaboradores, devo este sucesso sobretudo aos talentosos jovens cientistas Dr. Hossein Batebi e Dr. Guillermo Pérez-Hernández da minha equipa.” Na Universidade de Leipzig, os receptores acoplados à proteína G também são o foco do Collaborative Research Center (CRC) 1423, Structural Dynamics of GPCR Activation and Signaling, liderado pela professora Annette Beck-Sickinger.
Tom Gotze
Título original da publicação em ,,Nature Structural & Molecular Biology”:
Insights mecanísticos sobre o acoplamento da proteína G com um receptor acoplado à proteína G ligado ao agonista; doi.org/10.1038/s41594’024 -01334-2
Título original da publicação na ,,Nature”:
Crio-EM resolvido no tempo de ativação da proteína G por um GPCR; doi: 10.1038/s41586’024 -07153-1