Como os patógenos invadem os pulmões? Usando microtecidos pulmonares humanos, uma equipe do Biozentrum da Universidade de Basileia descobriu a estratégia usada por um patógeno perigoso. A bactéria tem como alvo células pulmonares específicas e desenvolveu uma estratégia sofisticada para romper a linha de defesa dos pulmões.
No início deste ano, a OMS publicou uma lista de doze dos agentes patogénicos bacterianos mais perigosos do mundo que são resistentes a múltiplos antibióticos e representam uma grave ameaça para a saúde humana. Esta lista inclui Pseudomonas aeruginosa, um patógeno nosocomial muito temido que causa pneumonia grave e potencialmente fatal. Este patógeno é especialmente ameaçador para pacientes imunocomprometidos e em ventilação mecânica, com taxas de mortalidade de até 50%.
A barreira pulmonar é penetrável
Pseudomonas aeruginosa desenvolveu uma ampla gama de estratégias para invadir os pulmões e o corpo. Pesquisadores liderados pelo professor Urs Jenal, do Biozentrum, Universidade de Basel, obtiveram agora novos insights sobre o processo de infecção usando microtecidos pulmonares cultivados em laboratório, gerados a partir de células-tronco humanas. Na revista científica Microbiologia da Naturezaeles descrevem como Pseudomonas rompe a camada superior do tecido pulmonar e invade áreas mais profundas. Este estudo foi realizado como parte do Centro Nacional de Competência em Pesquisa (NCCR) “AntiResist”.
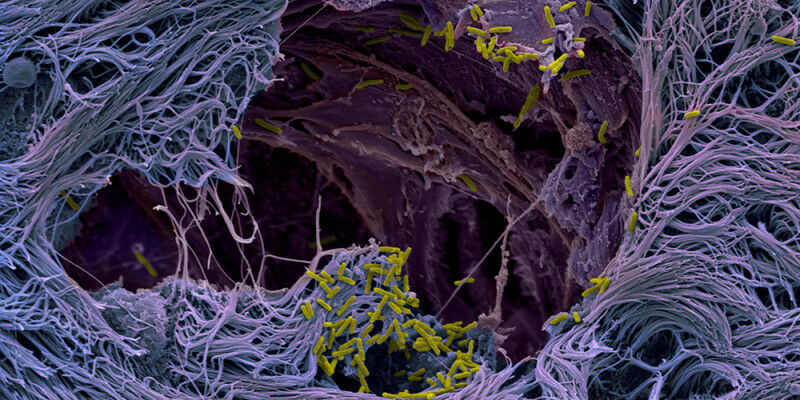
Nossos pulmões são revestidos por uma fina camada de células compactadas que protege as camadas mais profundas do tecido pulmonar. A superfície é coberta por muco, que retém partículas como microorganismos e é removido das vias aéreas por células especializadas. Esta camada serve como uma barreira eficaz quase impenetrável contra patógenos invasores. No entanto, Pseudomonas as bactérias encontraram uma maneira de rompê-lo. Mas como o patógeno atravessa a barreira tecidual permaneceu um mistério até agora.
Organoides pulmonares fornecem novos insights sobre infecções em humanos
“Crescemos microtecidos pulmonares humanos que imitam de forma realista o processo de infecção dentro do corpo do paciente”, explica Jenal. “Esses modelos pulmonares nos permitiram descobrir a estratégia de infecção do patógeno. Ele usa as células caliciformes produtoras de muco como cavalos de Tróia para invadir e cruzar o tecido de barreira. Ao atingir as células caliciformes, que constituem apenas uma pequena parte da mucosa pulmonar, as bactérias podem romper a linha de defesa e abrir o portão.”
Com um grande arsenal de fatores de virulência, conhecidos como sistemas de secreção, o patógeno ataca e invade especificamente as células caliciformes, replica-se dentro das células e, por fim, mata-as. A explosão das células mortas leva a rupturas na camada de tecido, causando vazamento na barreira protetora. Os patógenos exploram esse ponto fraco: eles colonizam rapidamente os locais de ruptura e se espalham para regiões mais profundas dos tecidos.
Novo sensor para monitoramento de bactérias
Usando organoides pulmonares humanos, os cientistas conseguiram elucidar as sofisticadas estratégias de infecção de Pseudomonas. No entanto, ainda não está claro como os patógenos adaptam seu comportamento durante o processo de infecção. Por exemplo, eles devem primeiro ser móveis para se espalharem pela superfície do tecido, depois aderirem rapidamente às células pulmonares após contato e, posteriormente, ativarem seus fatores de virulência. Sabe-se que as bactérias podem mudar rapidamente seu comportamento graças a pequenas moléculas sinalizadoras. Até agora, porém, a tecnologia para estudar estas correlações não estava disponível.
A equipe de Jenal desenvolveu agora um biossensor para medir e rastrear uma pequena molécula sinalizadora chamada c-di-GMP em bactérias individuais. O método foi descrito recentemente em Comunicações da Natureza. “Este é um avanço tecnológico”, diz Jenal. “Agora podemos monitorar em tempo real e com alta resolução como essa molécula sinalizadora é regulada durante a infecção e como ela controla a virulência do patógeno. Agora temos uma visão detalhada de quando e onde as células bacterianas individuais ativam determinados programas para regular seu comportamento. Este método nos permite investigar infecções pulmonares com mais detalhes.”
Modelos de órgãos imitam condições em pacientes
“Graças ao desenvolvimento dos organoides pulmonares humanos, agora temos uma compreensão muito melhor de como os patógenos se comportam nos tecidos humanos e, presumivelmente, nos pacientes”, enfatiza Jenal. “Isso nos aproxima um grande passo do objetivo do NCCR AntiResist.” Organoides do pulmão humano e de outros órgãos como a bexiga permitem aos pesquisadores estudar os efeitos dos antibióticos nos tecidos, por exemplo, identificando onde e como as bactérias sobrevivem durante o tratamento. Tais modelos de órgãos serão indispensáveis no futuro para o desenvolvimento de estratégias novas e eficazes para combater patógenos.
Publicações originais
A. Leoni Swart, Benedict-Joseph Laventie, Rosmarie Sütterlin, Tina Junne, Luisa Lauer, Pablo Manfredi, Sandro Jaconia, Xiao Yu, Evdoxia Karagkiozi, Rusudan Okujava e Urs Jenal.
A invasão de células caliciformes promove a ruptura do epitélio respiratório por um patógeno humano oportunista.
Microbiologia da Natureza (2024), doi: 10.1038/s41564’024 -01718-6
Andreas Kaczmarczyk, Simon van Vliet, Roman Peter Jakob, Raphael Dias Teixeira, Inga Scheidat, Alberto Reinders, Alexander Klotz, Timm Maier, Urs Jenal.
Um biossensor geneticamente codificado para monitorar mudanças dinâmicas de c-di-GMP com alta resolução temporal.
Comunicações da Natureza (2024), doi: 10.1038/s41467’024 -48295-0